Peroxidy acetonu

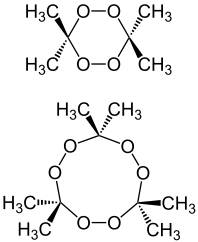

Peroxidy acetonu (TATP nebo TCAP, DADP a TeACP nebo TeACTP či TeACTeP) jsou skupinou velmi nebezpečných třaskavin. Existuje dimerní forma – (DADP – Di-Aceton-Di-Peroxid), trimerní forma – (TATP – Tri-Aceton-Tri-Peroxid) a tetramerní forma – (TeACP nebo TeACTeP – jeho existence je ale debatovaná). V praxi se téměř výlučně setkáváme s trimerem (TATP – triperoxid acetonu) nebo vzácněji s dimerem (DADP – diperoxid acetonu), popř. jejich směsí. Dále existují dva „monomery“ (dimethyldioxiran, 2,2-propandiyldihydroperoxid) a především chlorované verze peroxidů acetonu.
Peroxidy acetonu jsou pravděpodobně nejčastěji amatérsky vyráběnou třaskavinou. Jedná se o častý zdroj těžkých nehod, především amputací, v důsledku exploze gramových množství ve vzdálenosti několika centimetrů od rukou (např. 5 g 3 cm od prstů). Proto je nutno vždy držet alespoň 10 - 15 cm odstupu mezi peroxidy acetonu a prsty (platí pro množství do 2 gramů)
Historie[editovat | editovat zdroj]
Aceton peroxid byl objeven v roce 1895 německým chemikem Richardem Wolffensteinem,[1] který jako první chemik použil anorganických kyselin jako katalyzátorů. Jako první také získal výzkumný patent pro využití peroxidu jako výbušné směsi. Bayer a Villiger publikovali v roce 1900 první postup syntézy dimeru a popis použití kyselin pro syntézu obou peroxidů. Další informace o syntéze, včetně údajů o podílu vzniklých sloučenin – monomeru, dimerů, a trimerů je také dostupné v článku Milase a Goluboviće.[2]
Za minulého režimu se v ČR (resp. ČSSR) staly peroxidy acetonu oblíbenou náhražkou tehdy nedostupné zábavní pyrotechniky. Široké povědomí o peroxidech acetonu je po desítky let udržováno především běžnými přednáškami na chemických vysokých školách, kde je zdůrazňováno riziko náhodné syntézy těchto látek při styku koncentrovaného peroxidu vodíku s acetonem v kyselém prostředí (popř. při oxidaci diisopropyletheru vzduchem).
Vlastnosti[editovat | editovat zdroj]
Peroxidy acetonu jsou obvykle bílé krystalické látky s nízkou teplotou tání (v praxi připravené někde kolem 98 °C), které lze snadno vyrobit z běžně dostupných chemikálií – peroxidu vodíku v koncentraci vyšší nebo rovné 3 %, acetonu a kyseliny chlorovodíkové (méně ideálně i dalších kyselin). Jejich citlivost odpovídá průměrným třaskavinám, jsou tedy krajně citlivé na náraz, tření, statickou elektřinu, UV záření nebo změny teploty. Běžné výboje statické elektřiny (viditelné i neviditelné) z konečků prstů a oblečení jsou dokonale schopné běžné třaskaviny – tedy i peroxidy acetonu odpálit. Zvláště pokud daná osoba pracuje v suchém vzduchu (pod 70 % relativní vlhkosti – běžné v topné sezóně). Mohou explodovat samovolně i za horkého dne při teplotách nad 50 °C vlivem reakce kyseliny sírové uzavřené v krystalech peroxidu acetonu (při použití kyseliny sírové jako kyselého katalyzátoru v průběhu výroby). Jsou značně fyzikálně nestálé, mají sklon k sublimaci a již po několika dnech může dojít k rozkladu vlivem nečistot, popř. vzniku větších a o něco citlivějších krystalů – čistý a suchý peroxid acetonu je chemicky poměrně stálý. Peroxidy acetonu jsou rozpustné v toluenu a acetonu. Jejich skladování za pomoci rozpuštění v acetonu ale nelze doporučit, v roztoku jsou vlivem nečistot (i vody) rapidně rozkládány. Naopak rekrystalizované TATP je v čistých rozpouštědlech stabilní.
Je potřeba zdůraznit, že citlivost třaskavin není stálá vlastnost. Typicky udávané citlivosti jsou udávané jako síly, popř. energie potřebné k odpálení 50 nebo 10 % vzorků. Ale např. v 1 případě z 1000 bude stačit i 70× menší síla. Nezkušení amatéři během pár pokusů často zjistí, že citlivost peroxidů acetonu „není až tak veliká“ a myslí si, že odborníci a zkušení amatéři zbytečně straší – toto je bohužel důsledek pravděpodobnosti. A pak se během několika dalších pokusů stanou obětí toho případu, kdy je potřeba k odpálení peroxidů acetonů mnohem menší impuls (to je ten 1 případ z 1000). Samotné přesypávání na papíře je schopno generovat statické výboje a třecí síly potřebné k občasnému odpálení peroxidu acetonu (tj. ten 1 případ z 1000). Pokud tedy začátečník připraví 10 náložek, tak se vystavuje asi 1% riziku amputace prstů. Proto je potřeba vždy za všech okolností dodržovat bezpečnostní pokyny – viz wikikniha peroxidy acetonu.
Peroxoaceton je znám jako jedna z nejsilnějších výbušnin neobsahující v molekule atomy dusíku. Díky jednoduchosti přípravy je oblíbeným materiálem teroristů[zdroj?], kteří s ním mohou nepozorovaně projít detektory určenými pro detekci trhavin na bázi nitrosloučenin. Vysoká tenze par TATP/DADP ji ale předurčuje ke zjištění jinými instrumentálními metodami, popř. psy.[3][4]
Dobře promytý a čistý peroxid acetonu má nasládlou ovocnou vůni. Sypná hustota peroxidu acetonu je mezi 0,3 až 0,4 g/cm3. Krystalová hustota triperoxidu je 1,22 g/cm3.
Výroba a nakládání s peroxidem acetonu[editovat | editovat zdroj]
Neodborná manipulace s peroxidy acetonu je odpovědná za značné množství nehod, především se jedná o amputace prstů. Proto se doporučuje seznámit se s obecnými pravidly pro zacházení s třaskavinami a peroxidy acetonu.

Amputace po explozi se velmi špatně léčí. Traumatické amputace za plného vědomí (tedy bez anestézie, typicky „uspání“) také téměř vždy (80 – 90 % případů) vedou ke vzniku fantomové bolesti končetiny.[5]
Jen v ČR připravily za poslední 3 desetiletí peroxidy acetonu o prsty a často i sluch a zrak stovky mladíků. Například Patrik Pospíšil přišel kvůli peroxidům acetonu o ruku, zrak a krátkodobě i o sluch.[1] Je proto potřeba se přípravy peroxidů acetonu vyvarovat, popř. přísně dodržovat bezpečnostní pokyny (viz odkaz na wikiknihu peroxidy acetonu na konci článku).
Výbušinářské vlastnosti peroxidů acetonu[editovat | editovat zdroj]
Při explozi dosahuje lehce až silně menší explozivní síly nežli tritol (při typických hustotách má detonační rychlost 2000 až 4000 m/s, detonační rychlost při hustotě 0,4 g/cm3 je kolem 2660 m/s, detonační tlak od přibližně 10 kbar při sypné hustotě po 30 kbar při středně silném stlačení a kolem 80 kbar při slisování ke krystalové hustotě. a impuls tlakové vlny dosahuje 55 % TNT, (popř. až 80 % dle různých zdrojů ). Brizance dle Hesse při hustotě 0,4 g/cm3 je třetinová oproti TNT (tj. sypané TNT s hustotou 1,2 g/cm3). Výbuch 1,36 g vytvoří ve vzdálenosti 5,2 cm maximální přetlak 20 atm a celkový impuls tlakové vlny 0,35 atm.ms. 50 g peroxidu acetonu vytvoří tlakovou vlnu, která má 3 m od místa výbuchu impuls pozitivní fáze 9,65 kPa.ms s maximálním tlakem 18 kPa – pro srovnání 20 kPa je spodní hranice pro protržení ušních bubínků a při 100 kPa praskne 50 % ušních bubínků.. Energie exploze peroxidu acetonů se pohybuje kolem 2 800 kJ/kg (tedy asi 70 % TNT). Na internetu často mylně zmiňované hypotézy o entropické explozi vedoucí k produkci přibližně 400 l/kg chladné směsi acetonu a ozónu jsou čirým nesmyslem. Ve skutečnosti produkuje TATP 855 l/kg a DADP 713 l/kg plynu (měřeno v heliu). Zvěsti o entropické explozi pochází primárně ze studie Dubnikové et al. z roku 2004. Tato studie je ovšem mystifikcí – je nesmyslně napsaná tak, aby vyvolala senzaci – to je důsledek dnešní publish or perish kultury ve vědě. Pojem entropická exploze se v expandovaném pojetí jejich konceptu ve skutečnosti vztahuje jen na jevy během iniciálních 100 ps v reakční zóně – hned na to dochází ke klasické redoxní reakci a produkci vody, oxidů uhlíku a uhlovodíků. Krystal TATP dosáhne během detonace teploty 2300 K a tlaku 80 kbar.[6]
Detonace TATP v heliu podléhá rovnici.
C9H18O6 →1.30 CO2 + 2.44 CO + 2.61 CH4 + 0.63 C2H6 + 0.23CmHm + 0.47 H2 + 0.96 H2O + 0.47C
TATP lze oproti HMTD slisovat až blízko ke krystalové hustotě. U TATP neexistuje přelisování, ale iniciační mohutnost i tak klesá (a to jak u velmi vysokých tak i nízkých hustot) a maxima dosahuje kolem 0,5 – 0,7 g/cm3. DADP má relativně slabou iniciační schopnost a přechod od deflagrace k detonaci vyžaduje veliká množství (gramy) a pevnou dutinku.
Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
- ↑ WOLFFENSTEIN, R. Über die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd. Chemische Berichte. 1895, roč. 28, s. 2265.
- ↑ Milas N. A., Golubović A. Studies in Organic Peroxides. XXVI. Organic Peroxides Derived from Acetone and Hydrogen Peroxide. Journal of the American Chemical Society. 1959, roč. 81, čís. 24, s. 6461–6462. DOI 10.1021/ja01533a033.
- ↑ GENUTH, Iddo, Lucille Fresco-Cohen. TATP: Countering the Mother of Satan [online]. The Future of Things, 6 November 2006 [cit. 2009-09-24]. Dostupné online.
- ↑ Feds are all wet on airport security [online]. Star-Ledger, 24 August 2006 [cit. 2009-09-11]. Dostupné online.[nedostupný zdroj]
- ↑ The Experience of Phantom Limb Pain in Patients With Combat-Related Traumatic Amputations. www.sciencedirect.com [online]. [cit. 20.11.2018]. Dostupné online.
- ↑ ADRI C. T. VAN DUIN*†, YEHUDA ZEIRI‡§, FAINA DUBNIKOVA‡, RONNIE KOSLOFF‡, AND WILLIAM A. GODDARD†. Atomistic-Scale Simulations of the Initial Chemical Events in the Thermal Initiation of Triacetonetriperoxide. J. Am. Chem. Soc [online]. [cit. 9.5.2018]. Dostupné online.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu peroxidy acetonu na Wikimedia Commons
Obrázky, zvuky či videa k tématu peroxidy acetonu na Wikimedia Commons  Kniha Výbušniny/Peroxidy acetonu ve Wikiknihách
Kniha Výbušniny/Peroxidy acetonu ve Wikiknihách
