Hydrogensíran sodný
| Hydrogensíran sodný | |
|---|---|
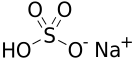 Vzorec | |
 Model | |
 Vzhled, je přiložen i pH papírek dokazující nízké pH | |
| Obecné | |
| Systematický název | Hydrogensíran sodný |
| Ostatní názvy | Bisulfát sodný (zastaralý název) |
| Sumární vzorec | NaHSO4 |
| Vzhled | Bílá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7681-38-1 |
| Vlastnosti | |
| Molární hmotnost | 120,06 g/mol (bezvodý) 138,07 g/mol (monohydrát) |
| Teplota tání | 58,5 °C; tj. 331,5 K (monohydrát) 315 °C; tj. 558 K (bezvodý) |
| Teplota rozkladu | 315 °C; 588 K (na H2O a Na2S2O7) |
| Hustota | 2,742 g/cm3 (bezvodý) 1,8 g/cm3 (monohydrát) |
| Disociační konstanta pKa | 1,99 |
| Rozpustnost ve vodě | 50 g/100 ml (0 °C) 100 g/100 ml (100 °C) |
| Struktura | |
| Krystalová struktura | jednoklonná (monohydrát); trojklonná (bezvodý) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H318 |
| R-věty | R34 R37 R41 |
| S-věty | S26 S36 S37 S39 S45 |
| NFPA 704 |  0
1
1
|
Některá data mohou pocházet z datové položky. | |
Hydrogensíran sodný je bílá krystalická anorganická látka se vzorcem NaHSO4. Jedná se o sodnou sůl kyseliny sírové, kde je nahrazen jen jeden ze dvou vodíků sodíkem, což způsobuje, že pH jeho vodných roztoků je kyselé (1molární roztok dosahuje pH cca 1).
Výroba[editovat | editovat zdroj]
Tato látka je obvykle vyráběna reakcí hydroxidu sodného a kyseliny sírové, dle rovnice:
Důležité pro tuto reakci je, že není použito velké množství hydroxidu sodného, aby nedocházelo ke vzniku síranu sodného. Reakce probíhá se zředěnými, zahřátými roztoky, které jsou v průběhu míchány.
Obdobně lze použít místo hydroxidu chlorid. Reakce pak probíhá následně:
Vzniklý produkt je obvykle kontaminovanější (v porovnání s hydroxidovou výrobou), avšak je mnohem levnější díky nízké ceně a vysoké dostupnosti chloridu sodného.
Reakce[editovat | editovat zdroj]
Tato látka se chová velice obdobně jako kyselina sírová. Z mnoha látek (kupříkladu z octanu sodného) přebíhá sodný iont a nahrazuje ho svým vodíkovým iontem, reaguje tedy:
Tato reakce může probíhá obdobně s uhličitanem, chloridem, fosforečnanem, dusičnanem, a jinými látkami.
Tato látka se při zahřívání na vysokou teplotu (t>315 °C) rozkládá, vzniká disíran sodný a voda, dle rovnice:
Tato reakce je však vratná.
Použití[editovat | editovat zdroj]
Tato látka se běžně používá na snižování pH, je totiž méně nebezpečná v porovnání třeba s kyselinou sírovou. Hydrogensíran sodný se používá jako přídatná látka (spolu se síranem sodným pod označením E 514). Dále bývá používán jako dezinfekce bazénů, zabraňuje totiž množení bakterií.
Reference[editovat | editovat zdroj]
- ↑ a b Sodium hydrogen sulfate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Hydrogensíran sodný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Hydrogensíran sodný na Wikimedia Commons





![{\displaystyle \mathrm {2\,NaHSO_{4}\ {\xrightarrow[{}]{t}}\ Na_{2}S_{2}O_{7}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbe3aea3ed02469f3760f11ff57c5d3e0dbbbae2)