Fluorid zlatičný
| Fluorid zlatičný | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid zlatičný |
| Anglický název | gold(V) fluoride (systematický název) gold pentafluoride |
| Německý název | Goldpentafluorid |
| Sumární vzorec | Au2F10 (dimer) AuF5 (monomer, v pevném skupenství se nevyskytuje) |
| Vzhled | červená nestabilní pevná látka |
| Identifikace | |
| Registrační číslo CAS | 57542-85-5 |
| Vlastnosti | |
| Molární hmotnost | 291,959 g/mol (monomer) 583,918 g/mol (dimer) |
| Teplota tání | 60 °C (rozklad) |
| Hustota | ? |
| Rozpustnost ve vodě | rozklad |
| Struktura | |
| Krystalová struktura | kosočtverečná |
| Bezpečnost | |
Některá data mohou pocházet z datové položky. | |
Fluorid zlatičný je anorganická sloučenina se vzorcem Au2F10 (dimer) (Monomerní forma se v pevném skupenství nevyskytuje). Jedná se o sloučeninu zlata v nejvyšším oxidačním čísle. Tato červená pevná látka je rozpustná v kyselině fluorovodíkové, ovšem tento roztok se rozkládá za uvolnění fluoru.
Výroba[editovat | editovat zdroj]
Au2F10 se vyrábí zahříváním kovového zlata v kyslíkovo–fluorové atmosféře při teplotě 370 °C a tlaku 8 atmosfér za vzniku dioxygenylfluoridu[1]:
2 Au(s) + O2(g) + 3 F2(g) → O2AuF6(s).
Dioxygenylfluorid se pak rozkládá při 180 °C za vzniku fluoridu zlatičného:
2 O2AuF6(s) → Au2F10(s) + 2 O2(g) + F2(g).
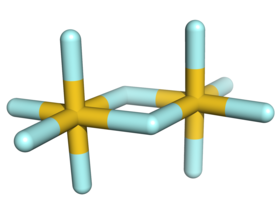
Struktura[editovat | editovat zdroj]
Au2F10 je jediný známý dimerní fluorid s prvkem v oxidačním čísle V; ostatní jsou buď monomerní (P, As, Sb, Cl, Br, I), tetramerní (Nb, Ta, Cr, Mo, W, Tc, Re, Ru, Os, Rh, Ir, Pt), nebo polymerní (Bi, V, U).[2]
V plynném skupenství se vyskytuje směs dimeru a trimeru v poměru 82:12.
Reaktivita[editovat | editovat zdroj]
Fluorid zlatičný je nejsilnější známý akceptor fluoridového aniontu, silnější než fluorid antimoničný.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Gold(V) fluoride na anglické Wikipedii.
- ↑ EMELÉUS, H. J.; SHARPE, A. G. Advances in Inorganic Chemistry and Radiochemistry. [s.l.]: Academic Press, 1983. ISBN 0-12-023627-3. S. 83.
- ↑ In-Chul Hwang, Konrad Seppelt "Gold Pentafluoride: Structure and Fluoride Ion Affinity" Angewandte Chemie International Edition 2001, volume 40, 3690-3693. doi| 10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5



