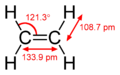Dvojná vazba (chemie)

Jako dvojná vazba se v chemii označuje chemická vazba mezi dvěma atomy, jíž se účastní čtyři vazebné elektrony namísto obvyklých dvou. Nejčastější dvojnou vazbu, mezi dvěma atomy uhlíku, lze nalézt v alkenech. Existuje mnoho typů dvojných vazeb mezi různými prvky; například v karbonylové skupině mezi atomem uhlíku a atomem kyslíku. Jinými hojně rozšířenými dvojnými vazbami jsou vazby v azosloučeninách (N=N), iminech (C=N) a sulfoxidech (S=O). Ve strukturních vzorcích se dvojná vazba znázorňuje dvěma rovnoběžnými čarami mezi atomy.[1] Mezi stejnými dvěma atomy je dvojná vazba obecně silnější a kratší než vazba jednoduchá. Pokud molekula obsahuje dvě nebo více dvojných vazeb, označujeme je podle polohy jako kumulované, konjugované nebo izolované.
- Běžné chemické sloučeniny s dvojnou vazbou
Princip dvojné vazby[editovat | editovat zdroj]
Princip dvojné vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů. Například v ethenu má každý atom uhlíku tři sp2 orbitaly a jeden p-orbital. Tři sp2 orbitaly leží v jedné rovině se třemi 120° úhly mezi nimi. Nehybridizovaný p-orbital je kolmý k této rovině. Když se tyto dva atomy uhlíku přiblíží, jeden ze tří sp2 orbitalů na prvním uhlíku vytvoří σ vazbu s příslušným sp2 orbitalem na druhém uhlíku. Ve stejnou chvíli spolu výše zmíněné p-orbitaly vytvoří vazbu druhou (π vazbu). Kvůli maximálnímu překryvu orbitalů (silnější vazba) k sobě zůstávají p-orbitaly v rovnoběžné poloze, a proto není obecně možná rotace kolem dvojné vazby. Z této vlastnosti pramení cis- a trans- izomerie.

Odkazy[editovat | editovat zdroj]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Double bond na anglické Wikipedii.
- ↑ Organic Chemistry 2nd Ed. John McMurry
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons
Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons