Dusičnany
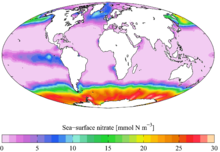
Dusičnany (ledky, nitráty) jsou soli kyseliny dusičné, obsahují tedy aniont NO3- o molární hmotnosti 62,01 gramů na mol. Jelikož jsou bohaté na dusík, podstatná část vyrobených dusičnanů se užívá jako hnojiva. Tyto látky mají rovněž vlastnosti oxidačních činidel, proto se užívají v pyrotechnice, kupříkladu na výrobu střelného prachu aj. Dusičnany se vyskytují i v přírodě, existuje několik nerostů s dusičnany, avšak jejich těžba by nebyla schopna pokrýt celosvětovou spotřebu, proto se vyrábí uměle. Dusičnany jsou zastoupeny i v mořské vodě, viz mapu zastoupení. Nadměrné zastoupení dusičnanu v mořské vodě umožňuje život fytoplanktonu (například v oblasti Aljašky), nadměrné zastoupení ve sladké vodě (zejména jezerech) způsobuje množení řas a sinic Téměř všechny dusičnany jsou ve vodě dobře rozpustné.

Dusičnany alkalických kovů
Tyto dusičnany jsou bílé, krystalické látky, rozpustné ve vodě. Lze je připravit reakcí kyseliny dusičné s příslušným hydroxidem. Při zahřívání se rozpadá na dusitan a kyslík, dle reakce (Me označuje prvek alkalického kovu):
2MeNO3 —t→ 2|MeNO2 + O2
Díky vzniklému kyslíku jsou tyto dusičnany dobrými oxidačními činidly. Tyto látky mají velký průmyslový význam.
Dusičnan sodný
Dusičnan sodný (NaNO3) se triviálně nazývá chilský ledek. Je to bílá krystalická látka, vyskytuje se v přírodě v nerostu zvaném nitronatrit, avšak vyrábí se uměle. Své uplatnění nalézá v pyrotechnice i jako hnojivo. Vyrábí se reakcí oxidu dusnatého, oxidu dusičitého, kyslíku a uhličitanu sodného.
NO + NO2 + Na2CO3 + O2 → 2 NaNO3 + CO2
Laboratorní příprava spočívá v neutralizaci hydroxidu sodného kyselinou dusičnou dle následující rovnice:
NaOH + HNO3 → NaNO3 + H2O
Dusičnan draselný
Dusičnan draselný (KNO3), triviální název ledek draselný či sanytr. Tuto látku lze připravit z dusičnanu sodného, tento způsob výroby dusičnanu draselného se nazývá konverze. Laboratorně je možné ho vyrábět neutralizací hydroxidu draselného kyselinou dusičnou dle následující rovnice:
KOH + HNO3 → KNO3 + H2O
Používá se jako draselné a dusíkaté hnojivo nebo jako sůl k nasolování masa Sanytr (E252). Dusičnan draselný je též nejvýznamnější složkou původního černého střelného prachu.
Dusičnany kovů alkalických zemin
Tyto ve vodě rozpustné látky při zahřívání tvoří oxid kovu a oxid dusičitý:
MeNO3 —t→ MeO + NO2
Tyto látky mají své uplatnění obvykle v pyrotechnice, skoro vůbec se neužívají jako hnojiva.
Dusičnan vápenatý
Dusičnan vápenatý, též zvaný vápenatý ledek (Ca(NO3)2). V čistém stavu je to bílá, krystalická látka rozpustná ve vodě. Připravuje se rozpouštěním uhličitanu nebo hydroxidu v kyselině dusičné. Používá se jako poněkud neobvyklé, vápenaté hnojivo.
Dusičnan barnatý
Dusičnan barnatý je ve vodě rozpustná látka se vzorcem Ba(NO3)2. Díky barnatým iontům barví plamen do zelena, čímž se stává důležitou látkou pro pyrotechniku, zejména na zelený bengálský oheň.
Dusičnan strontnatý
Dusičnan strontnatý (Sr(NO3)2)) barví plamen červeně a je proto součástí složí pro červený bengálský oheň. Mnohdy bývá nahrazován mnohem levnějším dusičnanem vápenatým, který nemá tak pěkné efekty jako dusičnan strontnatý.
Tato látka se vyrábí reakcí uhličitanu strontnatého s kyselinou dusičnou:
SrCO3 + 2HNO3 → Sr(NO3)2 + CO2 + H2O
Dusičnany přechodných kovů
Tyto ve vodě rozpustné látky při zahřívání tvoří oxid kovu a oxid dusičitý:
MeNO3 —t→ MeO + NO2
Tyto látky se neužívají obvykle jako pyrotechnika ani hnojiva. Často se užívají v chemii na další syntézy.
Dusičnan stříbrný
Dusičnan stříbrný (AgNO3). Nazývá se též lapis infernalis nebo pekelný kamínek. Vzniká reakcí stříbra s kyselinou dusičnou. Je bezbarvý a jako jedna ze dvou solí stříbra (společně s fluoridem) se rozpouští ve vodě. Užívá se v lékařství, chemii jako skupinové činidlo aniontů 2. třídy a je základem chemických procesů ve fotografii. Tato látka se vyrábí reakcí horké kyseliny dusičné s kovovým stříbrem.
3Ag + 4HNO3 → 3AgNO3 + 2H2O + NO
Tato látka se užívá na analýzy halogenidových iontů. Reaguje s nimi za vzniku sraženin bílého chloridu, žlutého jodidu či světle žlutého bromidu stříbrného.
Tato látka se při vystavení světlu rozpadá na kovové stříbro, díky čemuž se zabarvuje do šeda.
Dusičnan měďnatý
Dusičnan měďnatý, jehož vzorec je Cu(NO3)2, je modrá, hygroskopická látka dobře rozpustná ve vodě. Vzniká reakcí mědi s kyselinou dusičnou. Je-li kyselina zředěná, probíhá reakce takto:
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
S koncentrovanou kyselinou probíhá reakce takto:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Dusičnan olovnatý
Dusičnan olovnatý je bílá, hygroskopická látka, která se užívá na výrobu výbušného azidu olovnatého a tetraethylolova na zvýšení oktanového čísla benzínu a chromové žluti (chromanu olovnatého). Dnes se již olovnaté benzíny používají jen v několika zemích, z této látky se však stále vyrábí azid olovnatý a chromová žluť, která je však postupně omezována. Tato látka se vyrábí průmyslově rozpouštěním kovového olova v kyselině dusičné.
Dusičnany s nekovovými kationty
Tyto dusičnany mají místo atomu kovu v molekule jiný prvek či skupinu látek. Vlastnosti jsou pro každý dusičnan individuální.
Dusičnan amonný
Dusičnan amonný, též zvaný ledek amonný, je látka se vzorcem NH4NO3. Užívá se k výrobě výbušnin a hnojiv. Při žíhání se rozpadá na oxid dusný a vodu:
NH4NO3 → N2O + 2 H2O
Vyrábí se exotermní reakcí amoniaku s kyselinou dusičnou či podvojnou záměnou síranu amonného a dusičnanu sodného:
NH3 + HNO3 → NH4NO3
(NH4)2SO4 + 2 NaNO3 → Na2SO4 + 2 NH4NO3
Tato látka má průmyslový význam, zejména na výrobu rajského plynu.
Organické dusičnany
Kyselina dusičná je schopna reagovat s alkoholy za vzniku esterů. Tyto látky mají na molekule navázanou skupinu NO3-, který se označuje předponou nitroxy, ale je běžné se setkat s nitro. Některé mají průmyslový význam, část má význam jako trhaviny a některé jsou důležitými biochemickými látkami. Část z nich lze vyrobit reakcí organické sloučeniny s kyselinou dusičnou za přítomnosti kyseliny sírové, nebo fosforečné (nelze tak připravit zejména 1,3,5-cyklotrimethylentrinitramin, jelikož reaguje s kyselinou sírovou i fosforečnou. Jako alternativa se v tomto případě užívá dusičnan amonný.) Zde je několik příkladů nitrátů:
Nitroglycerín
Nitroglycerín (glycerol-trinitrát) je nažloutlá olejovitá kapalina, velice snadno exploduje při nárazech či zahřívání na vysokou teplotu, je důležitou látkou na výrobu trhavin, zejména dynamitu. Rovněž má význam jako lék na srdeční arytmii. Tato látka je jedovatá, při požití zužuje cévy, což může vyvolat ve velkých dávkách smrt. Vyrábí se nitrací glycerolu za přítomnosti kyseliny sírové:
- HOCH2CH(OH)CH2OH + 3HNO3 → O2NOCH2CH(ONO2)CH2ONO2 + 3H2O
Nitrocelulóza
Nitrocelulóza, též „střelná bavlna“ je vysoce hořlavá látka, vzhledem podobná bavlně. Vyrábí se reakcí celulózy s kyselinou dusičnou za přítomnosti kyseliny sírové nebo fosforečné. Tato látka se užívá na výrobu bezdýmého střelného prachu a dříve na fotografie jako film. Při zapálení tato látka prudce shoří beze zbytku.
Vzhled dusičnanů
Na následujících obrázcích je možno vidět vzhled některých dusičnanů:
-
Dusičnan zinečnatý Zn(NO3)2
-
Dusičnan vápenatý Ca(NO3)2
-
Dusičnan stříbrný AgNO3 (Je patrná přítomnost stříbra na povrchu)
-
Dusičnan sodný NaNO3
-
Dusičnan olovnatý Pb(NO3)2
-
Dusičnan kobaltnatý Co(NO3)2
-
Dusičnan kademnatý Cd(NO3)2
-
Dusičnan hořečnatý Mg(NO3)2
-
Dusičnan hlinitý Al(NO3)3
-
Dusičnan draselný KNO3
-
Dusičnan bismutitý Bi(NO3)3
-
Dusičnan barnatý Ba(NO3)2
-
Dusičnan manganatý Mn(NO3)2
-
Dusičnan amonný NH4NO3
-
Dusičnan strontnatý Sr(NO3)2













