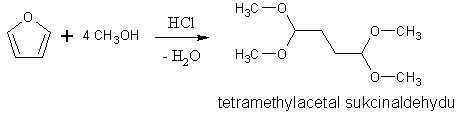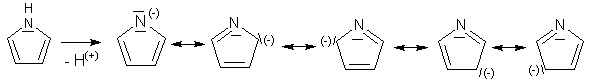Aromatické heterocyklické sloučeniny
Aromatické heterocyklické sloučeniny jsou heterocyklické sloučeniny, které mají aromatický charakter, neboť splňují pravidla aromaticity.
Přehled vybraných zástupců[editovat | editovat zdroj]
Pětičlenné heterocykly[editovat | editovat zdroj]
Fyzikálně-chemickými metodami bylo zjištěno, že furan, thiofen a pyrrol jsou rovinné útvary s vazbami délky přibližně odpovídající průměru jednoduché a dvojné vazby. Počet π elektronů je 4 (atomy C) + 2 (heteroatom), což odpovídá Hückelovu pravidlu.
Jelikož elektronegativita klesá v řadě O > N > S, má furan největší snahu přitahovat π-elektrony, což se projeví nižší delokalizační energií.
| Vzorec | 
|

|

|
Benzen (Pro srovnání) |
| Název | furan | pyrrol | thiofen | |
| Delokalizační energie | 88,2 kJ/mol | 105,0 kJ/mol | 130,2 kJ/mol | 163 kJ/mol |
Vlivem heteroatomu dochází k nerovnoměrnému rozložení elektronových hustot a může vzniknout řada mezomerních struktur.
Nejvíce jsou preferovány první 2 struktury, protože mají náboje blízko u sebe. Do těchto poloh proto bývá usměrňována substituce.
Šestičlenné heterocykly[editovat | editovat zdroj]
Dalším typickým představitelem aromatických heterocyklů je pyridin (delokalizační energie 88,2 kJ/mol). Nejvyšší elektronová hustota je v poloze 3. Nahrazením dalšího atomu C dusíkem získáme 3 izomery.
Dvojjaderné heterocykly[editovat | editovat zdroj]
Tříjaderné heterocykly[editovat | editovat zdroj]
Reakce aromatických heterocyklů[editovat | editovat zdroj]
Reakční centrum je jak na heteroatomu, tak i na jádře. U vícejaderných heterocyklů musíme brát ohled na to, že reakce mohou probíhat i na jádře bez heteroatomu.
Reakce na heteroatomu[editovat | editovat zdroj]
Stálost vůči kyselinám[editovat | editovat zdroj]
Furan a pyrrol nejsou kvůli své vysoké elektronegativitě stálé vůči silným kyselinám. Dochází k štěpení heterocyklického jádra. To lze za mírných podmínek použít k přípravě některých sloučenin.
Bazicita síry v thiofenu je natolik malá, že je vůči kyselinám stálý.
Kyselost pyrrolu a indolu[editovat | editovat zdroj]
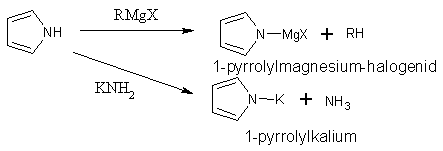
Pyrrol a indol mají slabě kyselé vlastnosti a proto reagují s Grignardovými činidly nebo amidem draselným.
Kyselost pyrrolu a indolu je způsobena tím, že se π-elektrony aniontu delokalizují po jádře a aniont je stabilizován.
Bazicita pyridinu, chinolinu a isochinolinu[editovat | editovat zdroj]
Pyridin, chinolin a isochinolin jsou slabé zásady, které se silnými kyselinami vytvářejí soli.
Reakce na jádře[editovat | editovat zdroj]
Elektrofilní substituce[editovat | editovat zdroj]
Pětičlenné heterocykly[editovat | editovat zdroj]
Furan a pyrrol jsou citlivé vůči silným kyselinám a proto se elektrofilní substituce nemohou provádět v silně kyselém prostředí (přímá halogenace, sulfonace, nitrace). Thiofen je odolnější, ale jako cyklický sulfid podléhá oxidaci (nelze použít nitrační směs). Proto je nutné použít jiné metody. Činidlem pro bromaci je dioxandibromid, pro sulfonaci pyridinium-1-sulfonát a pro nitraci acetylnitrát. Thiofen můžeme sulfonovat kyselinou sírovou. Uvedené substituce probíhají do polohy 2.
Friedelovu–Craftsovu acylaci lze uskutečnit pouze se slabšími Lewisovými kyselinami jako je chlorid cíničitý nebo etherát fluoridu boritého.
Uvedené elektrofilní substituce probíhají i s indolem do polohy 3.
Heteroatom natolik zvyšuje reaktivitu, že s furanem, pyrrolem a thiofenem probíhají některé reakce, které jsou s benzenem nemožné.
Pyridin a jeho benzology[editovat | editovat zdroj]
Rozložení elektronové hustoty pyridinu určuje elektrofilní substituci na atom dusíku a do polohy 3 (β). Z běžných elektrofilních substitucí lze uskutečnit halogenaci, nitraci a sulfonaci. Všechny tyto reakce probíhají v kyselém prostředí, kde vznikají pyridiniové soli a atom N je tak blokován. Reakce však musí probíhat v drastických podmínkách, protože reaktivita pyridinu je oproti benzenu značně snížená (srovnatelná s nitrobenzenem).
Protože je pyridinové jádro deaktivováno, probíhají elektrofilní substituce chinolinu a isochinolinu na benzenovém jádře – poloha 5 a 8.
Nukleofilní substituce[editovat | editovat zdroj]
Čičibabinova reakce[editovat | editovat zdroj]
Čičibabinova reakce je nukleofilní substituční reakce, při které zahříváním pyridinu (1) s amidem sodným ve vhodném rozpouštědle (např. xylenu) vzniká 2-aminopyridin (2). Podle elektronových hustot by reakce měla probíhat ještě v poloze 4. Preference polohy 2 je dána tím, že prvním krokem je adice amidu na dvojnou vazbu (3). Adice na vazbu C=N je snadnější než na vazbu C=C.
Podobně reaguje chinolin (poloha 2) a isochinolin (poloha 1).

|

|
Adice[editovat | editovat zdroj]
Cykloadice furanu[editovat | editovat zdroj]
Z pětičlenných heterocyklů se nejvíce blíží cyklopenta-1,3-dienu furan. Proto furan (podobně jako konjugované dieny) podléhá cykloadičním reakcím.
Redukce jádra[editovat | editovat zdroj]
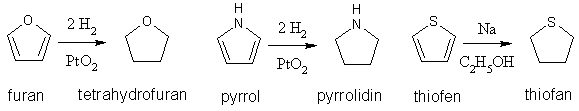
Mezi adice patří také redukce jádra. Tetrahydrofuran má vlastnosti cyklického etheru, pyrrolidin sekundárnímu aminu.
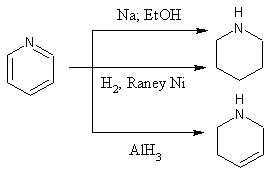
Pyridin lze redukovat na hexahydropyridin (piperidin) nebo na 1,2,3,4-tetrahydropyridin (3-piperidein). Piperidin vzniká redukcí sodíkem ve vroucím alkoholu (Ladenburgova redukce) nebo katalytickou hydrogenací na platině nebo Raneyově niklu. 3-piperidein vzniká redukcí hydridem hlinitým.
Oxidace alkylpyridinu a (iso)chinolinu[editovat | editovat zdroj]
Pyridin je vůči oxidaci (na rozdíl od benzenu) netečný a proto alkylové substituenty na pyridinovém jádře se mohou bezpečně oxidovat. Takto se připravuje kyselina nikotinová (z β-pikolinu) a isonikotinová (z γ-pikolinu), které patří mezi důležité farmaceutické meziprodukty.

|
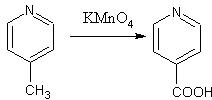
|
Oxidace chinolinu a isochinolinu postihuje benzenové jádro a vznikají pyridindikarboxylové kyseliny – chinolinová a cinchomeronová.

|

|
Syntéza[editovat | editovat zdroj]
Syntéza furanu, pyrrolu a thiofenu[editovat | editovat zdroj]
Základní přípravou 2,5-disubstitučních derivátů furanu, pyrrolu a thiofenu je Paalova-Knorrova reakce. Výchozí látkou jsou γ-diketosloučeniny, které působením dehydratačních činidel (oxid fosforečný) přechází na deriváty furanu, zahříváním s amoniakem nebo s primárními aminy vznikají deriváty pyrrolu a účinkem sulfidu fosforu (P4S7) přechází na deriváty thiofenu.
Protože je furan dobře dostupný (dá se vyrobit z furfuralu, který se získává zpracováním dřevěného odpadu), používá se i na přípravu pyrrolu a N-alkylpyrrolů. Páry furanu se spolu s amoniakem nebo primárním aminem a vodní párou vedou přes oxid hlinitý při teplotě okolo 400 °C.
Thiofen se dá získat z butanu, butenů nebo buta-1,3-dienu reakcí se sírou při asi 600 °C.
Syntéza indolu[editovat | editovat zdroj]
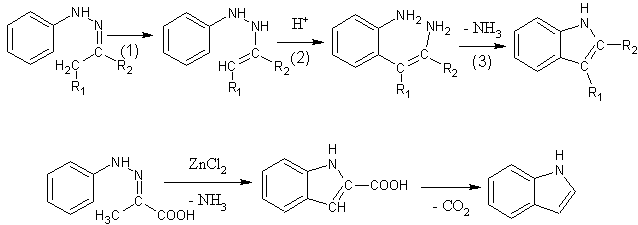
Indol a jeho deriváty se připravují především Fisherovou syntézou. Arylhydrazony se zahřívají s bezvodým chloridem zinečnatým, fluoridem boritým, polyfosforečnou kyselinou nebo kyselinou sírovou. Reakce probíhá v následujících krocích:
- Dochází k přesunu dvojné vazby a vzniká derivát hydrazinu.
- Vlivem kyselého prostředí dojde k o-benzidinovému přesmyku.
- Vzniklý diaminoderivát cyklizuje za odštěpení amoniaku,
Syntéza pyridinu a chinolinu[editovat | editovat zdroj]
Hlavním zdrojem pyridinu, chinolinu a jejich derivátů je černouhelný dehet.
β-pikolin lze připravit z glycerolu a amoniaku.
Deriváty pyridinu lze připravit Hantzschovou syntézou.
Ze získaných esterů 2,6-dimethyl-4-alkylpyridin-3,5-dikarboxylových kyselin lze hydrolýzou za varu a dekarboxylací získat 2,6-dimethyl-4-alkylpyridin.
Chinolin lze připravit Skraupovou syntézou.
Literatura[editovat | editovat zdroj]
- Červinka O., Dědek V., Ferles M.: Organická chemie, druhé přepracované vydání, SNTL, Praha
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Aromatické heterocyklické sloučeniny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Aromatické heterocyklické sloučeniny na Wikimedia Commons