Adamantan
| Adamantan | |
|---|---|
 Strukturní vzorec | |
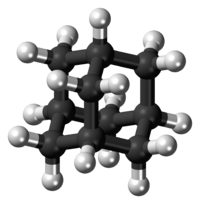 Model molekuly | |
 vzorek adamantanu | |
| Obecné | |
| Systematický název | tricyklo[3.3.1.13,7]dekan |
| Sumární vzorec | C10H16 |
| Vzhled | bílý prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 281-23-2 |
| EC-no (EINECS/ELINCS/NLP) | 206-001-4 |
| PubChem | 9238 |
| ChEBI | 40519 |
| SMILES | C1C3CC2CC(CC1C2)C3 |
| InChI | 1S/C10H16/c1-7-2-9-4-8(1)5-10(3-7)6-9/h7-10H,1-6H2 |
| Vlastnosti | |
| Molární hmotnost | 136,23 g/mol |
| Teplota tání | 270 °C (543 K) |
| Hustota | 1,07 g/cm3[1] |
| Index lomu | 1,568 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v uhlovodících |
| Tlak páry | 1,49 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H319 H400[1] |
| P-věty | P264+265 P273 P280 P305+351+338 P337+317 P391 P501[1] |
Některá data mohou pocházet z datové položky. | |
Adamantan je polycyklický uhlovodík se vzorcem (CH)4(CH2)6; jeho molekuly lze považovat za tři spojené cyklohexanové kruhy. Prostorové uspořádání atomů uhlíku je u něj stejné jako v krystalu diamantu; tato sloučenina je nejjednodušším zástupcem diamantoidů.
Deriváty adamantanu mají využití jako léčiva, polymery a teplotně stálá maziva.
Historie a příprava[editovat | editovat zdroj]
V roce 1924 navrhl H. Decker existenci adamantanu, který tehdy nazval dekaterpen.[2]
Adamantan se poprvé podařilo izolovat z hodonínské ropy v Ústavu technologie paliv a svítiv a technologie vody na počátku 30. let 20. století (izolace prezentována na XII. sjezdu průmyslové chemie roku 1932 v Praze).[3] Pokusy o umělou syntézu uspěly až o desetiletí později.
První pokus o jeho přípravu v laboratoři provedl roku 1924 Hans Meerwein prostřednictvím reakce formaldehydu a diethylmalonátu za přítomnosti piperidinu; místo adamantanu však získal 1,3,5,7-tetrakis(methoxykarbonyl)bicyklo[3.3.1]nonan-2,6-dion: tato sloučenina, později nazvaná Meerweinův ester, ale může být použita na přípravu adamantanu a jeho derivátů.[4] D. Bottger se pokusil o přípravu adamantanu z Meerweinova esteru, získal jeho derivát.[5]
Další pokusy byly založeny na floroglucinolu a derivátech cyklohexanonu, ale také neuspěly.[6]

První úspěšnou přípravu adamantanu předvedl Vladimir Prelog v roce 1941 s použitím Meerweinova esteru.[7][8] Výtěžnost této přípravy, složené z pěti kroků, byla 0,16 %, postup je tak prakticky nepoužitelný; lze však takto získat některé deriváty adamantanu.[6]

Prelogův postup byl v roce 1956 upraven; výtěžek dekarboxylace se podařilo zlepšit přidáním reakce Hunsdieckerových (11 %) a Hoffmanovy reakce (24 %), které zvýšily celkovou výtěžnost na 6,5 %.[9][10] Proces byl stále příliš složitý, v roce 1957 nalezl Paul von Ragué Schleyer vhodnější postup, kdy se nejprve hydrogenuje dicyklopentadien za přítomnosti katalyzátoru (například oxidu platiničitého) za tvorby tricyklodekanu a vzniklý produkt se poté působením Lewisovy kyseliny (například chloridu hlinitého) jako dalšího katalyzátoru převádí na adamantan. Takto lze získat adamantan s výtěžností 30–40 %; tento postup umožnil podrobnější zkoumání adamantanu a stále se používá v laboratořích.[11][12] Později se účinnost přípravy adamantanu podařilo navýšit na 60 %[13] a za působení ultrazvuku a katalýzy superkyselinami na 98 %.[14]

Výše uvedenými postupy vzniká adamantan jako polykrystalický prášek. Jednotlivé krystaly lze získat z jeho taveniny, roztoků i par. Nejhorší kvality se dosahuje u taveniny a nejlepší u roztoku, kde je ale krystalizace značně pomalá – k vytvoření 5–10mm krystalu je třeba několik měsíců; většinou se tak využívá plynné skupenství;[15] kde adamantan sublimuje v křemíkové trubici v peci vybavené zařízeními udržujícími určitý gradient teploty (kolem 10 °C/cm). Krystalizace začíná na jednom konci trubice, kde se udržuje teplota blízko teploty tuhnutí adamantanu. Při postupném ochlazování za zachování gradientu teplot se oblast tání posouvá (o přibližně 2 mm za hodinu) a vzniká monokrystal.[16]
Fyzikální vlastnosti[editovat | editovat zdroj]
Čistý adamantan je bezbarvá krystalická pevná látka s kafrovou vůní. Ve vodě se nerozpouští, ale je rozpustný v nepolárních organických rozpouštědlech.
Struktura[editovat | editovat zdroj]

Elektronovou difrakcí a rentgenovou krystalografií bylo zjištěno, že molekula adamantanu má symetrii typu Td. Délky vazeb uhlík–uhlík jsou 154 pm, téměř stejné jako u diamantu. Vzdálenosti mezi atomy uhlíku a vodíku činí 111,2 pm[17]
Za běžných podmínek krystalizuje adamantan v plošně centrované krychlové soustavě s prostorovou grupou Fm3m, a = 942,6 ± 0,8 pm, která obsahuje i molekuly s narušenou orientací. Tato struktura se může přeměňovat na uspořádanou primitivní čtverečnou (a = 664,1 pm, c = 887,5 pm), a to za teplot pod 208 K nebo tlaků nad 500 MPa.[6][18]
Tvrdost[editovat | editovat zdroj]
Základní hodnoty tenzoru pružnosti, C11, pro krystalové směry <110>, <111>, a <100>, jsou postupně 7,52, 8,20, a 6,17 GPa;[16] u diamantu mají hodnoty 1161, 1174, a 1123 GPa.[19] Uspořádání atomů uhlíku je u adamantanu stejné jako u diamantu.[20] V případě adamantanu ovšem molekuly netvoří kovalentní mřížku, ale interagují slabými Van der Waalsovými silami, v důsledku čehož jsou krystaly adamantanu měkké a tvárné.[15][16][21]
Spektroskopie[editovat | editovat zdroj]
NMR spektrum adamantanu obsahuje dva málo odlišené signály, které odpovídají místům 1 a 2 (viz obrázek níže). Chemické posuny při 1H-NMR jsou 1,873 a 1,756 ppm a u 13C-NMR 28,46 a 37,85 ppm.[22] Jednoduchý vzhled těchto spekter je v souladu s vysokou molekulovou symetrií.
Infračervené spektrum adamantanu obsahuje následující hlavní absorpční pásy:[17]
| Vlnočet, cm−1 | Odpovídající vibrace* |
|---|---|
| 444 | δ(CCC) |
| 638 | δ(CCC) |
| 798 | ν(C−C) |
| 970 | ρ(CH2), ν(C−C), δ(HCC) |
| 1103 | δ(HCC) |
| 1312 | ν(C−C), ω(CH2) |
| 1356 | δ(HCC), ω(CH2) |
| 1458 | δ(HCH) |
| 2850 | ν(C−H) v CH2 skupině |
| 2910 | ν(C−H) v CH2 skupině |
| 2930 | ν(C−H) v CH2 skupině |
* Typy vibrací: δ – deformační, ν – valenční, ρ a ω – deformační vibrace skupin CH2 vychylující je mimo rovinu
Optická aktivita[editovat | editovat zdroj]
Deriváty adamantanu, které mají na každém uzlovém uhlíku jiný substituent, jsou chirální.[23] Tato aktivita byla popsána v roce 1969 u derivátu majícího jako substituenty vodík, brom, methylovou, a karboxylovou skupinu. Specifické rotace bývají nízké, obvykle do 1°.[24][25]
Názvosloví[editovat | editovat zdroj]
Systematický název adamantanu je tricyklo[3.3.1.13,7]dekan; IUPAC ale doporučuje používání názvu "adamantan".[26]

Molekula adamantanu obsahuje pouze atomy uhlíku a vodíku a má symetrii typu Td. Polohu jeho 16 uhlíků a 10 vodíků tak lze popsat pomocí pouhých dvou míst, označovaných 1 (4 ekvivalentní místa) a 2 (6 ekvivalentních míst).
Podobnou strukturu nají noradamantan (obsahující o jednu skupinu CH2 méně) a homoadamantan (který má o jednu skupinu CH2 více).
Chemické vlastnosti[editovat | editovat zdroj]
Tvorba kationtů[editovat | editovat zdroj]
Adamantanový kation lze vytvořit reakcí 1-fluoradamantanu s fluoridem antimoničným; je poměrně stálý.[27][28]
Působením superkyselin lze vytvořit dikation 1,3-didehydroadamantanu. Tento kation je stabilizován „trojrozměrnou aromaticitou“[29] či homoaromaticitou.[30] Vzniklí tetracentrická dvouelektronová vazba je tvořena párem elektronu delokalizovaných na čtyřech atomech uhlíku.

Reakce[editovat | editovat zdroj]
Většina reakcí adamantanu probíhá na trikoordinovaných uhlících.
Působením koncentrované kyseliny sírové vzniká adamantanon.[31]

Karbonylová skupina adamantanonu může vstupovat do dalších reakcí, kterými lze získat například adamantan-2-karbonitril[32] a 2-methyladamantan.[33]
Bromace[editovat | editovat zdroj]
Adamantan snadno reaguje s bromačními činidly, například samotným bromem. Složení produktů závisí na podmínkách reakce, jako jsou přítomnost a druh katalyzátoru.[34]

Zahříváním směsi adamantanu a bromu se vytváří monosubstituovaná sloučenina adamantanu, 1-bromadamantan. Za přítomnosti Lewisovy kyseliny lze dosáhnout vícenásobné bromace.[35]
Lewisovy kyseliny bromaci urychlují, ozáření nebo přidání radikálů na její rychlost vliv nemá, což naznačuje, že reakce probíhá iontovým mechanismem.[6]
Fluorace[editovat | editovat zdroj]
První fluorace adamantanu byly provedeny pomocí 1-hydroxyadamantanu[36] a 1-aminoadamantanu. Pozdější fluorace využívaly i samotný adamantan.[37] U všech výše uvedených reakcí byl meziproduktem adamantanový kation, který následně reagoval s fluorovanými nukleofily; byly ale popsány i fluorace plynným fluorem.[38]
Karboxylace[editovat | editovat zdroj]
Karboxylací adamantanu kyselinou mravenčí vzniká kyselina 1-adamantankarboxylová.[39]

Oxidace[editovat | editovat zdroj]
1-hydroxyadamantan lze získat hydrolýzou 1-bromadamantanu ve směsi vody a acetonu, případně ozonací adamantanu:[40] Oxidací uvedeného alkoholu vzniká adamantanon.

Ostatní[editovat | editovat zdroj]
Nitrace adamantanu je obtížná.[41] Dusíkaté léčivo amantadin vzniká reakcí adamantanu s bromem nebo kyselinou dusičnou za vzniku sloučeniny s bromem nebo nitroesteovou skupinou v poloze 1. Reakcemi kterékoliv z těchto sloučenin s acetonitrilem se tvoří acetamid,který lze hydrolyzovat na 1-adamantylamin:[42]

Použití[editovat | editovat zdroj]
Samotný adamantan, jako nefunkcionalizovaný uhlovodík, nemá širší využití. Využití má při suchém leptání[43] a úpravách polymerů.
U barvivových laserů může adamantan prodlužovat životnost aktivního prostředí; nemůže být fotoionizován, protože se jeho absorpční pásy nacházejí v oblasti vakuového ultrafialového záření.[44]
V lékařství[editovat | editovat zdroj]
Některé deriváty adamantanu mají lékařská využití. Amantadin se v roce 1967 začal používat jako antivirotikum proti chřipce[45] a později také na léčbu Parkinsonovy nemoci.[46][47] K léčivům založeným na derivátech adamantanu patří také adapalen, adapromin, bromantan, karmantadin, chlodantan, dopamantin, memantin, rimantadin, saxagliptin, tromantadin, a vildagliptin. Polymery adamantanu mohou být použity proti HIV.[48]
Chřipkové viry si vyvinuly odolnost vůči amantadinu a rimantadinu, které od roku 2016 nejsou účinné proti převažujícím kmenům.
-
Adapalen
-
Adapromin
-
Amantadin
-
Bromantan
-
Memantin
-
Rimantadin
-
Saxagliptin
-
Tromantadin
-
Vildagliptin
Palivo vesmírných lodí[editovat | editovat zdroj]
Adamantan by mohl být používán jako hnací plyn ve vesmírných lodích, protože se snadno ionizuje, lze jej přechovávat v pevném stavu a nejsou tak potřeba vysokotlaké nádoby, a jeho toxicita je nízká.[49]
Ostatní[editovat | editovat zdroj]
Klecovitá struktura pevného adamantanu umožňuje zachytávání různých molekul, které lze po narušení matrice uvolnit do lidského těla.[13][50]
Analogy adamantanu[editovat | editovat zdroj]
Je známo mnoho dalších molekul se strukturou podobnou adamantanu, jako jsou oxid fosforitý (P4O6), oxid arsenitý (As4O6), oxid fosforečný (P4O10 = (PO)4O6), sulfid fosforečný (P4S10 = (PS)4S6), a hexamethylentetramin (C6N4H12 = N4(CH2)6).[51] Patří sem též tetramethylendisulfotetramin (zkráceně nazývaný „tetramin“), rodenticid, který je silně toxický pro člověka a ve většině zemí je tak zakázán. V roce 2005 byl získán křemíkový analog adamantanu, silaadamantan.[52]
Arsenicin A je přírodní organoarsenová sloučenina vyskytující se v mořských houbách druhu Echinochalina bargibanti; jedná se o první známý heterocyklus obsahující více než jeden atom arsenu.[53][54][55][56]
-
Adamantan
-
Hexamethylentetramin
-
Oxid fosforečný
-
Sulfid fosforečný
-
Tetramethylendisulfotetramin
-
Arsenicin A
Spojením více adamantanových jednotek do jednoho polycyklu vznikají vyšší diamantoidy, například diamantan (C14H20 – ze dvou adamantanů), triamantan (C18H24), tetramantan (C22H28), pentamantan (C26H32), a hexamantan (C26H30). Připravují se podobně jako adamantan, a také je lze izolovat z ropy, i když v mnohem menších množstvích.
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Adamantane na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/9238
- ↑ H. Decker. Versammlung deutscher Naturforscher und Ärzte. Angewandte Chemie. 1924, s. 795. DOI 10.1002/ange.19240374102. Bibcode 1924AngCh..37..781..
- ↑ VÍCHA, Robert; POTÁČEK, Milan. Kde roste adamantan. Chemické listy. 2004, roč. 98, s. 68 – 74. Dostupné online [cit. 2023-12-14].
- ↑ RADCLIFFE, Marc D.; GUTIERREZ, Alberto; BLOUNT, John F.; MISLOW, Kurt. Structure of Meerwein's ester and of its benzene inclusion compound. Journal of the American Chemical Society. 1984, s. 682–687. Dostupné v archivu pořízeném z originálu dne 2011-08-09. DOI 10.1021/ja00315a037.
- ↑ Coffey, S. and Rodd, S. (eds.) (1969) Chemistry of Carbon Compounds. Vol 2. Part C. Elsevier Publishing: New York.
- ↑ a b c d Fort, Raymond C.; SCHLEYERS, PAUL VON R. Adamantane: Consequences of Diamondoid Structure. Chemical Reviews. 1964, s. 277–300. DOI 10.1021/cr60229a004.
- ↑ Prelog V., Seiwerth R. Über die Synthese des Adamantans. Chemische Berichte. 1941, s. 1644–1648. DOI 10.1002/cber.19410741004.
- ↑ Prelog V., Seiwerth R. Über eine neue, ergiebigere Darstellung des Adamantans. Chemische Berichte. 1941, s. 1769–1772. DOI 10.1002/cber.19410741109.
- ↑ STETTER, H.; BANDER, O.; NEUMANN, W. Über Verbindungen mit Urotropin-Struktur, VIII. Mitteil.: Neue Wege der Adamantan-Synthese. Chemische Berichte. 1956, s. 1922. DOI 10.1002/cber.19560890820.
- ↑ MCKERVEY, M. Synthetic approaches to large diamondoid hydrocarbons. Tetrahedron. 1980, s. 971–992. DOI 10.1016/0040-4020(80)80050-0.
- ↑ Schleyer, P. von R. A Simple Preparation of Adamantane. Journal of the American Chemical Society. 1957, s. 3292. DOI 10.1021/ja01569a086.
- ↑ SCHLEYER, P. VON R.; DONALDSON, M. M.; NICHOLAS, R. D.; CUPAS, C. Adamantane. Org. Synth.. 1973.; Coll. Vol.. S. 16.
- ↑ a b G. Ali Mansoori. Molecular building blocks for nanotechnology: from diamondoids to nanoscale materials and applications. [s.l.]: Springer, 2007. ISBN 978-0-387-39937-9. S. 48–55.
- ↑ Steven V. Ley, Caroline M. R. Low. Ultrasound in Synthesis. [s.l.]: [s.n.]
- ↑ a b WINDSOR, C. G.; SAUNDERSON, D. H.; SHERWOOD, J. N.; TAYLOR, D.; PAWLEY, G. S. Lattice dynamics of adamantane in the disordered phase. Journal of Physics C: Solid State Physics. 1978, s. 1741–1759. DOI 10.1088/0022-3719/11/9/013. Bibcode 1978JPhC...11.1741W.
- ↑ a b c DRABBLE, J. R.; HUSAIN, A. H. M. Elastic properties of adamantane single crystals. Journal of Physics C: Solid State Physics. 1980, s. 1377–1380. DOI 10.1088/0022-3719/13/8/008. Bibcode 1980JPhC...13.1377D.
- ↑ a b Bagrii, E.I. Adamantanes: synthesis, properties, applications. [s.l.]: Nauka, 1989. Dostupné online. ISBN 5-02-001382-X. S. 5–57. (rusky)
- ↑ Vijayakumar, V. Pressure induced phase transitions and equation of state of adamantane. Journal of Physics: Condensed Matter. 2001, s. 1961–1972. DOI 10.1088/0953-8984/13/9/318. Bibcode 2001JPCM...13.1961V.
- ↑ Anastassakis, E.; SIAKAVELLAS, M. Elastic and Lattice Dynamical Properties of Textured Diamond Films. Physica Status Solidi B. 1999, s. 189–192. DOI 10.1002/(SICI)1521-3951(199909)215:1<189::AID-PSSB189>3.0.CO;2-X. Bibcode 1999PSSBR.215..189A.
- ↑ Mansoori, G. Ali. Principles of nanotechnology: molecular-based study of condensed matter in small systems. [s.l.]: World Scientific, 2005. Dostupné online. ISBN 981-256-154-4. S. 12.
- ↑ John Dalton Wright. Molecular crystals. [s.l.]: Cambridge University Press, 1995. ISBN 0-521-47730-1. S. 28.
- ↑ NMR, infračervená, a hmotnostní spektra adamantanu jsou umístěna v databázi SDBS Archivováno 6. 3. 2023 na Wayback Machine.
- ↑ March, J. Organic chemistry. Reactions, mechanisms, structure. Advanced course for universities and higher education chemical. [s.l.]: [s.n.], 1987. S. 137.
- ↑ Applequist, J.; RIVERS, P.; APPLEQUIST, D. E. Theoretical and experimental studies of optically active bridgehead-substituted adamantanes and related compounds. Journal of the American Chemical Society. 1969, s. 5705–5711. DOI 10.1021/ja01049a002.
- ↑ Hamill, H.; MCKERVEY, M. A. The resolution of 3-methyl-5-bromoadamantanecarboxylic acid. Chemical Communications. 1969, s. 864. DOI 10.1039/C2969000864a.
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 2014. ISBN 978-0-85404-182-4. DOI 10.1039/9781849733069-FP001. S. 169.
- ↑ Schleyer P. R.; FORT R. C.; WATTS W. E. Stable Carbonium Ions. VIII. The 1-Adamantyl Cation. Journal of the American Chemical Society. 1964, s. 4195–4197. DOI 10.1021/ja01073a058.
- ↑ OLAH, George A.; PRAKASH, G. K. Surya; SHIH, Joseph G.; KRISHNAMURTHY, V. V.; MATEESCU, Gheorge D.; LIANG, Gao; SIPOS, Gyorgy. Bridgehead adamantyl, diamantyl, and related cations and dications. Journal of the American Chemical Society. 1985, s. 2764–2772. DOI 10.1021/ja00295a032.
- ↑ Smith, W.; BOCHKOV A.; CAPLE, R. Organic Synthesis. Science and art. [s.l.]: [s.n.], 2001. ISBN 5-03-003380-7. S. 573.
- ↑ BREMER, Matthias; VON RAGUÉ SCHLEYER, Paul; SCHÖTZ, Karl; KAUSCH, Michael; SCHINDLER, Michael. Four-Center Two-Electron Bonding in a Tetrahedral Topology. Experimental Realization of Three-Dimensional Homoaromaticity in the 1,3-Dehydro-5,7-adamantanediyl dication. Angewandte Chemie International Edition in English. 1987, s. 761–763. DOI 10.1002/anie.198707611.
- ↑ GELUK, H. W.; KEIZER, V. G. Adamantanone. Organic Syntheses. 1973, s. 8. DOI 10.15227/orgsyn.053.0008.
- ↑ 2-Adamantanecarbonitrile Archivováno 10. 7. 2012 na Wayback Machine. Organic Syntheses, Coll. Vol. 6, p. 41 (1988); Vol. 57, p. 8 (1977)
- ↑ Schleyer P. R.; NICHOLAS R. D. The Preparation and Reactivity of 2-Substituted Derivatives of Adamantane. Journal of the American Chemical Society. 1961, s. 182–187. DOI 10.1021/ja01462a036.
- ↑ Synthesis of adamantane [online]. [cit. 2009-12-11]. Dostupné online. (rusky) Special practical problem for the students of IV year. Department of Petroleum Chemistry and Organic Catalysis MSU.
- ↑ A. N. Nesmeyanov. Basic organic chemistry. [s.l.]: [s.n.], 1969. S. 664.
- ↑ George A. Olah; WELCH, John T.; VANKAR, Yashwant D.; NOJIMA, Mosatomo; KEREKES, Istvan; OLAH, Judith A. Pyridinium poly(hydrogen fluoride): a convenient reagent for organic fluorination reactions. Journal of Organic Chemistry. 1979, s. 3872–3881. DOI 10.1021/jo01336a027.
- ↑ , George A. Olah; SHIH, Joseph G.; SINGH, Brij P.; GUPTA, B. G. B. Ionic fluorination of adamantane, diamantane, and triphenylmethane with nitrosyl tetrafluoroborate/pyridine polyhydrogen fluoride (PPHF). Journal of Organic Chemistry. 1983, s. 3356–3358. DOI 10.1021/jo00167a050.
- ↑ Shlomo Rozen; GAL, Chava. Direct synthesis of fluoro-bicyclic compounds with fluorine. Journal of Organic Chemistry. 1988, s. 2803–2807. DOI 10.1021/jo00247a026.
- ↑ Koch, H.; HAAF, W. 1-Adamantanecarboxylic acid. Organic Syntheses. 1964. DOI 10.15227/orgsyn.044.0001.
- ↑ Zvi Cohen; HAIM VARKONY; EHUD KEINAN; YEHUDA MAZUR. Tertiary alcohols from hydrocarbons by ozonation on silica gel: 1-adamantanol. Organic Syntheses. 1979, s. 176. DOI 10.15227/orgsyn.059.0176.
- ↑ George W. Smith; HARRY D. WILLIAMS. Some Reactions of Adamantane and Adamantane Derivatives. The Journal of Organic Chemistry. 1961, s. 2207–2212. DOI 10.1021/jo01351a011.
- ↑ I. K. Moiseev; R. I. DOROSHENKO; V. I. IVANOVA. Synthesis of amantadine via the nitrate of 1-adamantanol. Pharmaceutical Chemistry Journal. 1976, s. 450–451. DOI 10.1007/BF00757832.
- ↑ Keiji Watanabe et al. Resist Composition and Pattern Forming Process [online]. Bandwidth Market, 2001 [cit. 2005-10-14]. Dostupné v archivu pořízeném z originálu dne September 4, 2011.
- ↑ K. Lenzke; L. LANDT; M. HOENER. Experimental determination of the ionization potentials of the first five members of the nanodiamond series. The Journal of Chemical Physics. 2007, s. 084320. DOI 10.1063/1.2773725. PMID 17764261. Bibcode 2007JChPh.127h4320L.
- ↑ MAUGH, T. Panel urges wide use of antiviral drug. Science. 1979, s. 1058–1060. DOI 10.1126/science.386515. PMID 386515. Bibcode 1979Sci...206.1058M.
- ↑ Lynn Sonnberg. The Complete Pill Guide: Everything You Need to Know about Generic and Brand-Name Prescription Drugs. [s.l.]: Barnes & Noble Publishing, 2003. ISBN 0-7607-4208-1. S. 87.
- ↑ T. A. Blanpied, R. J. Clarke, J. W. Johnson. Amantadine inhibits NMDA receptors by accelerating channel closure during channel block. Journal of Neuroscience. 2005, s. 3312–3322. DOI 10.1523/JNEUROSCI.4262-04.2005. PMID 15800186.
- ↑ A. G. Boukrinskaia et al. Polymeric Adamantane Analogues [online].
- ↑ AIS-EHT1 Micro End Hall Thruster – Applied Ion Systems [online]. [cit. 2021-02-22]. Dostupné online.
- ↑ Hamid Ramezani; G. ALI MANSOORI. Diamondoids as Molecular Building Blocks for Nanotechnology. [s.l.]: [s.n.], 2007. Dostupné online. ISBN 978-0-387-39937-9. DOI 10.1007/978-0-387-39938-6_4. S. 44–71.
- ↑ J. J. Vitall. The Chemistry of Inorganic and Organometallic Compounds with Adamantane-Like Structures. Polyhedron. 1996, s. 1585–1642. DOI 10.1016/0277-5387(95)00340-1.
- ↑ Jelena Fischer; JUDITH BAUMGARTNER; CHRISTOPH MARSCHNER. Synthesis and Structure of sila-adamantane. Science. 2005, s. 825. DOI 10.1126/science.1118981. PMID 16272116.
- ↑ MANCINI, Ines; GUELLA, Graziano; FROSTIN, Maryvonne; HNAWIA, Edouard; LAURENT, Dominique; DEBITUS, Cecile; PIETRA, Francesco. On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine Sponge Echinochalina bargibanti. Chemistry: A European Journal. 2006, s. 8989–8994. DOI 10.1002/chem.200600783. PMID 17039560.
- ↑ TÄHTINEN, Petri; SAIELLI, Giacomo; GUELLA, Graziano; MANCINI, Ines; BAGNO, Alessandro. Computational NMR Spectroscopy of Organoarsenicals and the Natural Polyarsenic Compound Arsenicin A. Chemistry: A European Journal. 2008, s. 10445–10452. DOI 10.1002/chem.200801272. PMID 18846604.
- ↑ GUELLA, Graziano; MANCINI, Ines; MARIOTTO, Gino; ROSSI, Barbara; VILIANI, Gabriele. Vibrational analysis as a powerful tool in structure elucidation of polyarsenicals: a DFT-based investigation of arsenicin A. Physical Chemistry Chemical Physics. 2009, s. 2420–2427. DOI 10.1039/b816729j. PMID 19325974. Bibcode 2009PCCP...11.2420G.
- ↑ Di Lu; A. DAVID RAE; GEOFF SALEM; MICHELLE L. WEIR; ANTHONY C. WILLIS; S. BRUCE WILD. Arsenicin A, A Natural Polyarsenical: Synthesis and Crystal Structure. Organometallics. 2010, s. 32–33. DOI 10.1021/om900998q.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Adamantan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Adamantan na Wikimedia Commons


















