Chlorbutan
Chlorbutan (též butylchlorid) je společné označení čtyř izomerů se sumárním vzorcem C4H9Cl. Těmito izomery jsou:
- 1-chlorbutan (n-chlorbutan, n-butylchlorid)
- 2-chlorbutan (sec-butylchlorid)
- 1-chlor-2-methylpropan (isobutylchlorid)
- 2-chlor-2-methylpropan (terc-butylchlorid)
V prvních dvou případech jde o chlorovaný derivát n-butanu, ve druhých dvou isobutanu čili 2-methylpropanu. Termín chlorbutan může označovat též první z uvedených izomerů.
1-chlorbutan[editovat | editovat zdroj]
1-chlorbutan je derivát n-butanu odvozený substitucí vodíku na koncovém uhlíku atomem chloru. Za běžných podmínek jde o bezbarvou hořlavou kapalinu. Reaguje s kovovým lithiem na n-butyllithium:[1]
- 2 Li + C4H9Cl → C4H9Li + LiCl
2-chlorbutan[editovat | editovat zdroj]
2-chlorbutan je derivát n-butanu odvozený substitucí vodíku na vnitřním uhlíku.
1-chlor-2-methylpropan[editovat | editovat zdroj]
1-chlor-2-methylpropan je odvozen od isobutanu (2-methylpropanu) substitucí vodíku na koncovém uhlíku.
2-chlor-2-methylpropan[editovat | editovat zdroj]
2-chlor-2-methylpropan je odvozen od isobutanu substitucí vodíku na prostředním uhlíku. Jedná se o bezbarvou, těkavou, hořlavou a dráždivou kapalinu (dráždivost způsobuje hydrolýza a vznik HCl). Ve vodě se rozpouští špatně a navíc – jak již bylo řečeno – podléhá hydrolýze. Používá se hlavně jako výchozí molekula pro nukleofilní substituční reakce při výrobě různých látek, od alkoholů po alkoxidové soli.
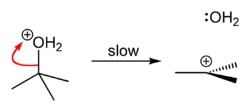
Při rozpouštění ve vodě, polárním a protickém rozpouštědle, se chloridový substituent odtrhává a je izolován od alifatického řetězce, čímž dochází k heterolytickému rozpadu sloučeniny a vzniká karbokation, který se může po reakci s molekulou vody stát terciárním alkoholem; uvolňuje se při tom kyselina chlorovodíková. Je-li při reakci přítomno jiné, silnější nukleofilní činidlo, nevzniká alkohol, nýbrž terciární sloučenina s nukleofilem jako substituentem.
Syntéza[editovat | editovat zdroj]
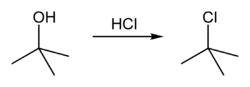
2-chlor-2-methylpropan lze v laboratoři syntetizovat SN1 reakcí terc-butanolu s koncentrovanou kyselinou chlorovodíkovou, vizníže.
 |
 |
 |
Celá reakce tedy vypadá takto:
Protože terc-butanol je terciárním alkoholem, relativní stabilita karbokationu terc-butyl v kroku 2 umožňuje, aby následoval mechanismus SN1; primární alkohol by potřeboval mechanismus SN2.
Reference[editovat | editovat zdroj]
V tomto článku byly použity překlady textů z článků 1-Chlorobutane na anglické Wikipedii a tert-Butyl chloride na anglické Wikipedii.
- ↑ Brandsma, L.; Verkraijsse, H. D. Preparative Polar Organometallic Chemistry I. Berlin: Springer-Verlag, 1987. ISBN 3-540-16916-4.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Chlorbutan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorbutan na Wikimedia Commons - Safety MSDS data
- Preparation 2-chloro-2-methylpropane
- http://www.cerlabs.com/experiments/10875407331.pdf